Acidi grassi polinsaturi (PUFA) Omega-3 e Omega-6 nella dieta vegetariana e vegana.
1. Struttura e biochimica
In biochimica il termine lipidi indica delle molecole insolubili in acqua e solubili in solventi non polari, costituiti da catene di atomi di carbonio, idrogeno e ossigeno, in alimentazione il termine usato è grassi, che a seconda della forma fisica (a temperatura ambiente) solida o liquida sono designati rispettivamente come grassi propriamente detti e oli. I grassi possono essere classificati ulteriormente in grassi saturi e grassi insaturi a seconda della presenza o meno di doppi legami nella catena idrocarburica. I grassi che presentano uno o più doppi legami carbonio-carbonio sono detti grassi insaturi, monoinsaturi presentano un solo doppio legame quindi una sola insaturazione, i polinsaturi presentano più doppi legami.
La presenza del doppio legame da luogo all’isomeria geometrica cis-trans: cis forma naturale in cui entrambi i carboni vinilici si trovano nella stessa parte del piano individuato dal doppio legame carbonio-carbonio, creando una sorta di piegamento dell’acido grasso; trans presenti naturalmente in piccole quantità nei cibi animali ma prodotti artificialmente dall’industria alimentare a partire dagli oli vegetali, in cui gli idrogeni vinilici si presentano in opposizione rispetto al piano stesso, e per questo presentano un piegamento molto meno vistoso, che li accomuna strutturalmente agli acidi grassi saturi. Gli acidi grassi omega 3 e omega 6 sono acidi grassi polinsaturi, nella nomenclatura comune la lettera omega e il numero 3 o 6 indica la posizione del doppio legame numerando dall’estremità opposta all’estremità carbossilica.
Gli acidi grassi omega 3 e omega 6 sono grassi essenziali cioè non sono prodotti dall’organismo devono essere pertanto assunti con l’alimentazione, essi contribuiscono in modo determinante alle caratteristiche chimico-fisiche del doppio strato fosolipidico delle membrane cellulari, assolvendo a compiti di tipo strutturale.
1.1 Omega 3 (18:3)
L’acido alfa linolenico (ALA 18:3) è costituito da una catena idrocarburica di 18 atomi di Carbonio, le insaturazioni sono 3 (C9,C12,C15), è il precursore degli acidi grassi polinsaturi a catena più lunga, l’acido Eicosapentaenoico (EPA C20:5) e Docosaesaenoico (DHA C22:5). EPA e DHA a loro volta, sono precursori, insieme all’acido arachidonico degli eicosanoidi (prostaglandine, leucotrieni, trombossani), gli eicosanoidi prodotti a partire dagli acidi polinsaturi omega 3 hanno effetti opposti rispetto alle rispettive molecole prodotte dall’acido arachidonico (AA). Ricordiamo gli effetti mediati dagli eicosanoidi derivanti dagli omega 3:
-
diminuiscono la pressione sanguigna;
-
diminuiscono i processi infiammatori;
-
diminuiscono l’aggregazione piastrinica;
-
diminuiscono la trombogenesi;
-
diminuiscono il vasospasmo;
-
diminuiscono le reazioni allergiche;
-
diminuiscono l’aggregazione piastrinica.
1.2 Omega 6 (18:2)
L’acido linoleico (LA 18:2 ) è una acido grasso con una catena idrocarburica di 18 atomi di carbonio e due insaturazioni in posizione C9 e C12 è il precursore dell’acido arachidonico (AA 20:4). L’acido arachidonico, a sua volta, è il precursore degli eicosanoidi (prostaglandine, leucotrieni, trombossani) con i seguenti effetti:
-
aumentano la pressione sanguigna;
-
aumentano i processi infiammatori;
-
aumentano l’aggregazione piastrinica;
-
aumentano la trombogenesi;
-
aumentano il vasospasmo;
-
aumentano le reazioni allergiche;
-
aumentano l’aggregazione piastrinica.
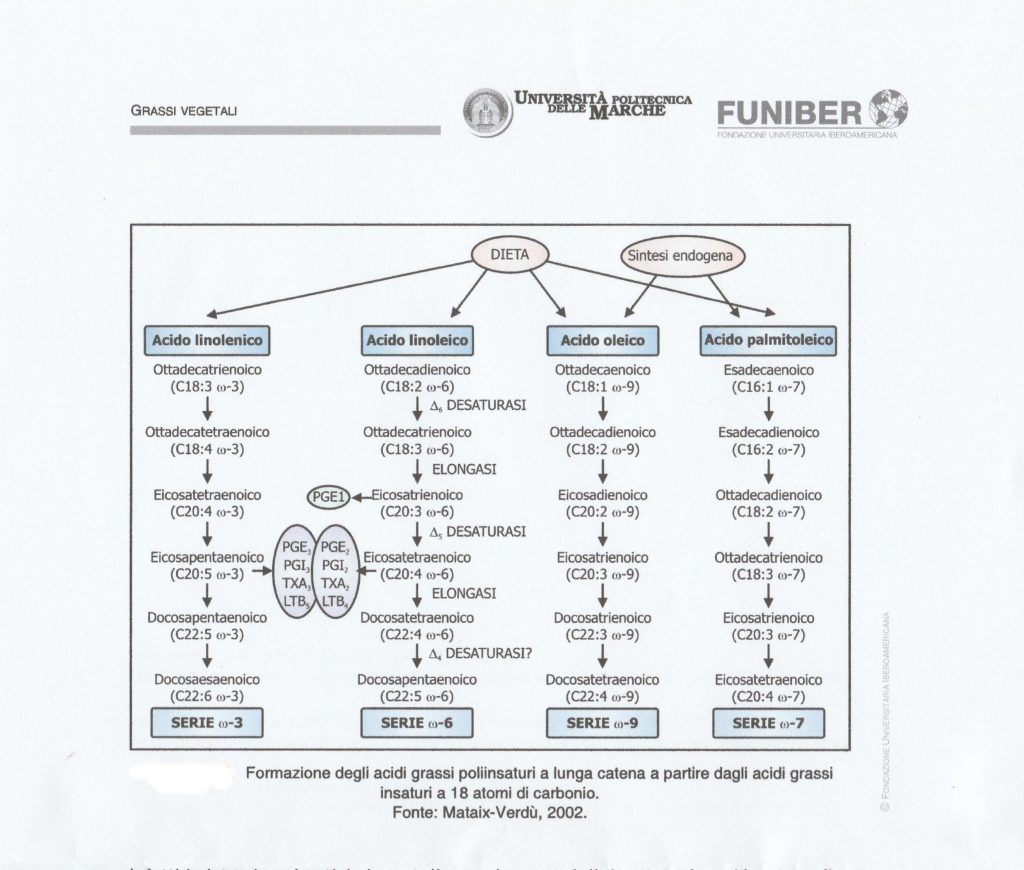
L’acido alfa linolenico e l’acido linoleico quando fungono da substrati nella via biosintetica per gli acidi grassi a catena più lunga condividono la stessa via metabolica e gli stessi enzimi come mostra la figura 1.1
I sistemi enzimatici che catalizzano i processi di desaturazione (desaturasi) e allungamento (elongasi) possono operare indistintamente su acidi grassi di qualunque delle serie nelle tappe corrispondenti. Questo produce fenomeni di competizione tra le differenti serie. La desaturasi e la elongasi, specialmente la delta-6-desaturasi, hanno maggiore affinità per gli acidi grassi con maggior grado di insaturazione (serie omega 3).
Questo effetto è controbilanciato e, in parte perfino contrastato, dalla maggiore quantità dei derivati della serie omega 6 nella dieta, questi aspetti sono molto importanti per le persone che scelgono la dieta vegetariana e vegana, infatti gli alimenti vegetali non sono fonti dirette di EPA e DHA. Nell’adulto sano, la bioconversione di ALA in EPA è generalmente inferiore al 10 %, mentre quella di ALA a DHA è inferiore e risulta del 5%. L’efficacia del processo d conversione, che risulta comunque più elevata nel sesso femminile è condizionata da una serie di fattori dietetici:
-
la conversione è ridotta dalla presenza di acido linoleico (LA) per il meccanismo di competizione del complesso enzimatico che si instaura a livello della via biosintetica, dove gli enzimi sono in comune. Nonostante gli enzimi abbiano predilezione per la serie omega 3, questa situazione viene ribaltata in presenza di elevate quantità di LA, quando nella dieta questo acido grasso raggiunge il 4,7 – 9,3% delle calorie totali la conversione dell’acido alfa linolenico negli acidi grassi a catena lunga viene ridotta del 50%;
-
per lo stesso meccanismo di competizione anche il rapporto acido linoleico : acido alfa linolenico appare condizionante la conversione di ALA in EPA e in DHA. Se negli antenati raccoglitori-cacciatori questo rapporto era di 1 a 1, le attuali raccomandazioni WHO/FAO sono di mantenerlo tra 5:1 e 10:1. il rapporto ottimale sembra essere di 2,3:1.
-
il contenuto totale dei grassi della dieta risulta essere in grado di ridurre la sintesi, ed è stato stimato che un contenuto di grassi intorno al 20% delle calorie totali appare molto più favorevole di un contenuto più elevato.
-
Altri fattori quali il consumo di acidi grassi trans e il diabete, possono ridurre l’efficacia dei processi di conversione;
-
l’enzima delta-6-desaturasi può essere insufficiente alla nascita, specialmente nei neonati prematuri.
2 Aspetti nutrizionali
Gli acidi grassi essenziali sono necessari per la formazione di membrane cellulari, il corretto sviluppo e funzionamento del cervello e del sistema nervoso e per la produzione di sostanze simili ad ormoni chiamate eicosanoidi (tromboxani, leucotrieni, prostaglandine). Gli esseri umani hanno la possibilità di convertire l’acido linoleico e alfa-linolenico in acidi grassi a catena più lunga che costituiscono i precursori degli eicosanoidi.
Le fonti primarie di acidi grassi essenziali sono i vegetali terrestri e marini. L’acido linoleico si trova soprattutto nei semi, noci, cereali e legumi. L’acido alfa-linolenico si trova nelle foglie verdi delle piante, incluso fitoplancton ed alghe, in alcuni semi, noci e legumi (lino, canola, noci e soia). L’acido arachidonico (AA) e l’acido docosoesanoico (DHA) sono ricavabili direttamente da cibi animali AA dalla carne e pollame e DHA e EPA dal pesce.
Ci sono due considerazioni fondamentali nella valutazione dell’adeguatezza di questi acidi grassi essenziali nella dieta: quantità e rapporto reciproco. L’Organizzazione Internazionale della Sanità (WHO) raccomanda che i grassi polinsaturi costituiscano fino al 3-7% delle calorie totali nella dieta [12], senza ulteriori precisazioni sulla quantità necessaria per ogni famiglia di grassi. Tuttavia gli esperti consigliano che si dovrebbe ottenere almeno il 3% dell’energia da acidi grassi omega-6 e lo 0.5% da acidi grassi omega-3. In molti oggi consigliano che i bambini e tutti coloro che non consumano alimenti contenenti EPA e DHA dovrebbero ottenere l’1% della loro energia da omega-3. Questa situazione riguarda i vegetariani e coloro che non mangiano pesce [13]. Sebbene non ci siano raccomandazioni definitive per le donne vegetariane durante la gravidanza e l’allattamento, potrebbe essere prudente aumentare l’assunzione di acido alfa-linolenico fino al 2% delle calorie, tenendo conto dell’importanza degli acidi grassi a lunga catena della famiglia degli omega-3 nello sviluppo del feto e dell’infante [14, 15, 16].
2.1Fonti di acidi grassi omega 3 e omega 6.
Gli acidi grassi omega 3 si trovano nei semi di lino, nell’olio dei semi di lino, nei semi di chia, nelle noci, nella soia, negli oli di: lino,soia canapa, oltre che in piccole quantità nella verdura a foglia verde e nelle alghe. Gli acidi grassi a catena più lunga della serie omega 3 EPA e DHA si trovano nei pesci grassi sono assenti nei vegetali, si trovano in piccola quantità nelle uova e nelle alghe. Pubblico la tabella nutrizionale dell’olio di semi di lino baule volante e la tabella nutrizionale dei semi di lino estrapolata dal database americano USDA.
Olio semi di lino baule volante spremuto a freddo “da frigo”
|
Valori medi per 100 ml |
|
|
Energia |
3404 kJ – 828 kcal |
|
Grassi |
92 g |
|
di cui: acidi grassi saturi |
8 g |
|
di cui: acidi grassi monoinsaturi |
16 g |
|
di cui acidi grassi polinsaturi |
63 g |
|
omega-3 |
49 g |
|
omega-6 |
14 g |
|
Carboidrati |
0 g |
|
di cui: zuccheri |
0 g |
|
Fibre |
0 g |
|
Proteine |
0 g |
|
Sale |
0 g |
Tabella 2.1 Valori nutrizionali dell’olio di semi di lino da frigo Baule volante.
Valori nutrizionali dei semi di lino ( solo la parte riguardante i grassi) dal databse USDA
-
Fatty acids, total saturated
3.663
4:0
0
6:0
0
8:0
0
10:0
0
12:0
0
14:0
0.008
15:0
0.005
16:0
2.165
17:0
0.018
18:0
1.33
20:0
0.052
22:0
0.052
24:0
0.031
Fatty acids, total monounsaturated
7.527
16:1
0.024
18:1
7.359
20:1
0.067
22:1
0.013
24:1 c
0.064
Fatty acids, total polyunsaturated
28.73
18:2
5.903
18:3
22.813
18:4
0
20:2 n-6 c,c
0.007
20:4
0
20:5 n-3 (EPA)
0
22:5 n-3 (DPA)
0
22:6 n-3 (DHA)
0
Cholesterol
0
Tabella 2.2 Composizione in grassi dei semi di lino (databse USDA)
Gli acidi grassi omega 6 sono contenuti in cereali integrali, frutta secca e semi oleaginosi,soia e in molti oli vegetali, di oliva, girasole, mais, sesamo, cartamo e di arachidi. Pubblico il contenuto in grassi dell’olio extra vergine di oliva estrapolato dal database italiano del CREA.
COMPOSIZIONE IN ACIDI GRASSI
|
Composizione |
g/100g di parte edibile |
|
|---|---|---|
|
Lipidi totali(%): 99.9 |
||
|
Saturi totali (%): |
14.46 |
|
|
C4:0÷C10:0 |
0 |
|
|
C12:0 |
0 |
|
|
C14:0 |
0 |
|
|
C16:0 |
10.64 |
|
|
C18:0 |
3.06 |
|
|
C20:0 |
0.76 |
|
|
C22:0 |
0 |
|
|
Monoinsaturi totali (%): |
72.95 |
|
|
C14:1 |
0 |
|
|
C16:1 |
0.79 |
|
|
C18:1 |
71.87 |
|
|
C20:1 |
0.29 |
|
|
C22:1 |
0 |
|
|
Polinsaturi totali (%): |
7.52 |
|
|
C18:2 |
6.79 |
|
|
C18:3 |
0.73 |
|
|
C20:4 (AA) |
0 |
|
|
C20:5 (EPA) |
0 |
|
|
C22:6 (DHA) |
0 |
|
|
Rapporto Polinsaturi/Saturi: |
0.5 |
|
tabella 2.3 composizione in acidi grassi dell’olio extra vergine di oliva (database CREA)
L’acido arachidonico (AA) e l’acido docosoesanoico (DHA) sono ricavabili direttamente da cibi animali, AA dalla carne e pollame e DHA e EPA dal pesce.
2.2 omega3 e omega 6: quantità da assumere durante la giornata.
Ci sono due considerazioni fondamentali nella valutazione dell’adeguatezza di questi acidi grassi essenziali nella dieta: quantità e rapporto reciproco. L’Organizzazione Internazionale della Sanità (WHO) raccomanda che i grassi poliinsaturi costituiscano fino al 3-7% delle calorie totali nella dieta [12], senza ulteriori precisazioni sulla quantità necessaria per ogni famiglia di grassi. Tuttavia gli esperti consigliano che si dovrebbe ottenere almeno il 3% dell’energia da acidi grassi omega-6 e lo 0.5% da acidi grassi omega-3. In molti oggi consigliano che i bambini e tutti coloro che non consumano alimenti contenenti EPA e DHA dovrebbero ottenere l’1% della loro energia da omega-3. Questa situazione riguarda i vegetariani e coloro che non mangiano pesce [13]. Sebbene non ci siano raccomandazioni definitive per le donne vegetariane durante la gravidanza e l’allattamento, potrebbe essere prudente aumentare l’assunzione di acido alfa-linolenico fino al 2% delle calorie, tenendo conto dell’importanza degli acidi grassi a lunga catena della famiglia degli omega-3 nello sviluppo del feto e dell’infante [14, 15, 16].
Un adulto che consumi 2000 kcal può raggiungere il minimo raccomandato del 3% di omega-6 e l’1% di omega-3 con 60 calorie di acido linoleico (6.7 g) e 20 calorie di acido alfa-linolenico (2.2 g). Ottenere 6.6 g di acido linoleico è facile praticamente in ogni tipo di dieta, perfino quelle che contengono bassissime quantità di grassi (10-15%). Gli omega-3 non sono altrettanto abbondanti nel nostro cibo, ai vegetariani e a coloro che non mangiano pesce è opportuno consigliare di includere regolarmente vegetali ricchi di omega-3 nella loro dieta. Gli Studiosi usano il rapporto tra acidi grassi omega-6 e omega-3 (omega-6:omega-3) per valutare l’equilibrio tra acidi grassi essenziali nella dieta. I Ricercatori di tutto il mondo raccomandano rapporti variabili tra 5:1 e 10:1 mentre alcuni Esperti ritengono che un rapporto compreso tra 1:1 e 4:1 sia ottimale [1]. Il rapporto attuale nella nostra dieta è stimato essere tra 14:1 e 20:1 con qualche Studio che indica rapporti più elevati nelle popolazioni vegetariane rispetto a quelle onnivore [17, 18].
2.3 fonti vegetali di omega 3 e fabbisogno umano
I vegetariani e i vegani non hanno fonti dirette di acido eicosapentaenoico (EPA) e docosoesanoico (DHA) (acidi grassi a lunga catena della famiglia degli omega-3) nella dieta e quindi devono convertire l’acido alfa-linolenico in EPA e DHA nell’organismo. I Ricercatori hanno messo in dubbio che questa conversione sia adeguata per soddisfare il fabbisogno umano di acidi grassi omega-3 a lunga catena. Studi scientifici suggeriscono che sebbene la conversione sia lenta e incompleta (forse solo il 10% dell’acido alfa-linolenico verrebbe convertito) [8] e sebbene i vegetariani tendano ad avere livelli ematici più bassi di acidi grassi omega-3 a lunga catena [19, 20], la conversione stessa sarebbe sufficiente per soddisfare il fabbisogno della maggior parte delle persone [21, 22].
È tuttavia importante notare che alcuni fattori possono deprimere l’attività degli enzimi necessari alla desaturazione dell’acido alfa-linolenico, influenzando così negativamente questo importante processo di conversione. Questi fattori sono: l’elevato consumo di grassi saturi, di grassi idrogenati, di colesterolo e di alcool, l’assunzione inadeguata di calorie o proteine, la carenza di alcuni nutrienti come lo Zinco e il Rame [5]. Ci possono anche essere problemi di conversioni nelle persone affette da diabete o altri disordini metabolici e per quelli che hanno una ereditaria limitata capacità di produrre enzimi di conversione (probabilmente in quei Paesi dove il pesce è stato uno dei componenti maggiori della dieta per secoli).
Inoltre, gli infanti convertono l’acido alfa-linolenico in DHA e EPA più lentamente che gli adulti. Alcuni Studi hanno evidenziato che i bambini prematuri non hanno la capacità di produrre quantità sufficienti di DHA e questo ha come conseguenza una compromissione dell’acuità visiva e del funzionamento dell’encefalo. Pertanto il DHA deve essere considerato in nutriente essenziale per questi bambini [23, 24]. Fino ad oggi, le formulazioni per l’infanzia disponibili in USA non sono fortificate con DHA, sebbene diversi produttori abbiano brevettato degli integratori di DHA per questo scopo, e si prevede che le formulazioni per l’infanzia fortificate con questo acido grasso essenziale dovrebbero essere introdotte nel mercato americano entro quest’anno [25]. Diversi Paesi Europei, tra cui la Gran Bretagna, il Belgio, l’Olanda, la Finlandia e la Spagna producono attualmente formulazioni fortificate con DHA.
I bambini allattati al seno generalmente ricevono ampie quantità di DHA attraverso il latte materno, sebbene le quantità varino considerevolmente in funzione dell’assunzione di acidi grassi omega-3 da parte della madre. Le madri vegetariane e vegane hanno minori concentrazioni di DHA nel latte [26, 27], sebbene i livelli di DHA dei loro bimbi appaiono essere solo leggermente inferiori a quelli dei figli di madri onnivore [28]. Un integratore a base di DHA ottenuto da una coltura di microalghe (sotto il nome commerciale di Neuromins) è attualmente disponibile nei negozi di prodotti naturali in tutto il Paese (negli USA, NdT).
2.4 Alimenti ricchi di omega 3 e relativa assunzione.
Le seguenti quattro linee guida aiuteranno a garantire adeguati quantità ed equilibrio di acidi grassi essenziali nelle diete vegetariane e vegane:
-
Limitare l’assunzione di grassi saturi e idrogenati. Nelle diete vegetariane le fonti primarie di grassi saturi sono i latticini e le uova, mentre le diete vegane contengono basse quantità di grassi saturi a meno che non vi sia un forte consumo di olii tropicali. Gli acidi grassi idrogenati derivano primariamente da olii vegetali idrogenati. Questi grassi hanno la capacità di interferire con la conversione dell’acido alfa-linolenico in DHA, oltre a aumentare il rischio di patologie degenerative. I grassi idrogenati sono abbondanti in merendine, margarine idrogenate, cibi elaborati che contengono olii vegetali idrogenati e parzialmente idrogenati (crackers, biscotti, torte, pasticcini, cibi economici surgelati, snack) e cibi da fast food (gli olii idrogenati sono usati per friggere in profondità).
-
Usare i grassi monoinsaturi come grassi principali nella propria alimentazione. I grassi monoinsaturi dovrebbero rappresentare la maggior parte dei grassi nella dieta, dato che hanno dimostrato di avere un effetto neutro o positivo per la salute. Inoltre incrementare i grassi monoinsaturi nella dieta aiuta a limitare l’assunzione di grassi saturi, grassi idrogenati ed omega-6. L’olio d’oliva (77% di grassi monoinsaturi) e/o l’olio di canola (58% di grassi monoinsaturi ) sono gli olii da preferire. Avocado, olive, nocciole, pistacchi, mandorle, noci macadamia, noccioline e pecan sono pure ottime fonti di grassi monoinsaturi. Questi cibi forniscono anche vitamine, minerali, sostanze fitochimiche e fibre e, se usati con moderazione, sono un ottimo complemento nelle diete vegetariane.
-
Limitare l’assunzione di olii vegetali ricchi di omega-6. Ridurre al minimo l’uso di olii ricchi in omega-6 è il modo più facile per mantenere l’acido linoleico a livelli accettabili. Tra gli olii che contengono soprattutto acidi grassi omega-6 ci sono l’olio di semi mais, di girasole, di cartamo, di cotone. I prodotti commerciali come le margarine, i condimenti per insalate e le maionesi che sono fatti con questi olii dovrebbero essere assunti in quantità limitata. L’olio di soia e di noci sono anch’essi ricchi di omega-6, ma il loro contenuto di omega-6 è parzialmente compensato dal contenuto di omega-3 di circa il 5-8%.
-
Includere una fonte di acidi grassi omega-3 nella dieta quotidiana. Per ottenere quantità sufficienti di omega-3 in una dieta vegetariana devono essere inserite nell’alimentazione di tutti i giorni delle buone fonti vegetali di questo nutriente. Se consideriamo un fabbisogno calorico giornaliero di 2000 Kcal, di cui il 5% fornito da acidi grassi poliinsaturi con un rapporto omega-6:omega-3 di 4:1, una persona necessiterebbe di 8.9 g di omega-6 e 2.2 g di omega-3. Non è un problema consumare 9 grammi di omega-6 anche in una dieta vegetariana a basso contenuto di grassi. .
La fonte più ricca di acido alfa-linolenico è l’olio di lino (57% omega-3, 15% omega-6). Altri cibi vegetali ricchi di omega-3 sono comunque delle fonti molto meno concentrate di questo nutriente, spesso unite a quantità molto più elevate di acido linoleico.
La Tabella 2.4 elenca alcune buone fonti vegetali di acido alfa-linolenico.
TABELLA 2,4 – Fonti vegetali di acidi grassi della famiglia degli Omega-3
|
CIBI (per porzione) |
Omega-3 (g) |
Omega-6 (g) |
|---|---|---|
|
Oli |
||
|
Olio di lino, 1 cucchiaio |
6.6 |
1.6 |
|
Olio di canola, 1 cucchiaio |
1.6 |
3.2 |
|
Olio di noce, 1 cucchiaio |
1.4 |
7.6 |
|
Olio di soia, 1 cucchiaio |
1.0 |
7.0 |
|
Noci e Semi |
||
|
Semi di lino, macinati, 2 cucchiai |
3.2 |
0.8 |
|
Noci, 2 cucchiai |
1.0 |
5.4 |
|
Verdura, frutta e legumi |
||
|
Semi di soia, cotti, 1 tazza |
1.1 |
7.8 |
|
Tofu, compatto, mezza tazza |
0.7 |
5.0 |
|
Tofu, medio, mezza tazza |
0.4 |
2.9 |
|
Latte di soia, 1 tazza |
0.4 |
2.9 |
|
Bacche, mezza tazza |
0.2 |
0.2 |
|
Piselli, mezza tazza |
0.2 |
0.2 |
|
Legumi, mezza tazza |
0.05 |
0.05 |
|
Vegetali a foglia verde |
||
|
Broccoli, cavolo, insalata, ecc. – 1 tazza se crudi o mezza tazza se cotti. |
0.1 |
0.03 |
|
Cereali |
||
|
Germe d’avena, 2 cucchiai |
0.2 |
1.6 |
|
Germe di grano, 2 cucchiai |
0.1 |
0.8 |
|
NdT: Si fa presente che l’indicazione di grandezze quali “cucchiaino”, “cucchiaio”, “tazza” ecc., non va considerata in modo approssimativo, ma rappresenta quantità precise, descritte nelle tabelle di conversione. |
||
NdT: Si fa presente che l’indicazione di grandezze quali “cucchiaino”, “cucchiaio”, “tazza” ecc., non va considerata in modo approssimativo, ma rappresenta quantità precise, descritte nelle tabelle di conversione.
2.5 Accorgimenti pratici nell’uso dei semi di lino e dell’olio di semi di lino.
L’olio ottenuto dai semi di lino è altamente insaturo e pertanto viene facilmente danneggiato dalla luce, dal calore e dall’aria. L’olio di semi di lino può essere acquistato nel reparto prodotti refrigerati dei negozi di prodotti naturali. È confezionato in bottiglie di plastica nera o vetro scuro per proteggerlo dalla luce. L’olio deve essere mantenuto nel frigorifero e si conserva fresco fino a 8 settimane dopo l’apertura. Bisogna controllare la data di scadenza: l’olio non usato entro quella data dovrebbe essere congelato. Normalmente dura per un anno o più nel freezer. L’olio di lino rancido ha un odore sgradevole e deve essere eliminato.
Esso non deve mai essere esposto al calore diretto e quindi non deve essere usato per cucinare. È ben utilizzarlo come base per il condimento dell’insalata o come un saporito condimento per la pasta, patate, riso, verdure (quello aromatizzato con aglio o peperoncino è un’ottima scelta). Può anche essere aggiunto a cereali caldi, minestre, salse, condimenti o frullati. Si può mescolare l’olio di lino con del burro o con margarina non idrogenata per ottenere una salsa da spalmare ricca di omega-3. L’olio può anche essere usato come integratore (1 o 2 cucchiaini al giorno o in forma di pillola per quelli che non ne amano il gusto).
I semi di lino integri sono protetti da un duro rivestimento esterno e durano per molti mesi nella dispensa. Sfortunatamente, dato che essi sono molto piccoli, generalmente arrivano intatti nel sistema digerente, da cui escono pure intatti. Per aumentare la digeribilità dei semi di lino si può semplicemente frantumarli con un frullatore od un macinacaffè. Essi possono essere acquistati nei negozi di prodotti naturali e in molti grossi negozi di prodotti alimentari. Una volta che i semi di lino sono stati macinati essi irrancidiscono alla svelta e devono essere conservati in frigorifero o nel congelatore.
I semi triturati possono essere sparsi sulle insalate o sui cereali. Le fibre solubili nel seme rendono la parte liquida delle minestre molto densa se vi rimangono immersi troppo a lungo. I semi di lino macinati possono essere anche un ottimo sostituto delle uova. Un cucchiaio di lino macinato mischiato a tre cucchiai di liquido sostituiscono un uovo nella cottura al forno. Questo sistema funziona particolarmente bene nei dolcetti, plumcake, biscotti e torte.
Avvertenze nell’uso dei semi di lino
I semi di lino assorbono acqua per 5 o 6 volte il loro peso e quindi è importante bere molti liquidi quando si consumino i semi macinati.
I semi crudi, ma non l’olio, contengono dei glucosidi cianogeni che sono convertiti nell’organismo in tiocianati. Queste sostanze chimiche possono interferire con l’utilizzo di Iodio da parte della tiroide e aumentare il rischio di gozzo (specialmente se lo Iodio nella dieta è scarso). Si consiglia di limitare il consumo di semi di lino crudi a 3-4 cucchiai al giorno. Il calore inattiva i glucosidi cianogeni e pertanto ci sono meno problemi quando i semi sono usati nella cottura al forno.
Bibliografia
-
Simopoulos AP Omega-3 fatty acids in health and disease and in growth and development, Am J Clin Nutr 1991 Sep;54(3):438-63.
-
Mantzioris E, James MJ, Gibson RA, Cleland LG Differences exist in the relationships between dietary linoleic and alpha-linolenic acids and their respective long-chain metabolites, Am J Clin Nutr 1995 Feb;61(2):320-4.
-
Salem N, Simopoulos AP, Galli C, Lagarde M, Knapp HR Fatty acids and lipids from cell biology to human disease, Salem N, Simopoulos AP, Galli C, Lagarde M, Knapp HR, eds, 1996;31(Suppl):S1-S326.
-
Lee K, Oilce Y, Kanazawa T The Third International on Nutrition in Cardiovascular Diseases, Annals NY Acad Sci 1993;676..
-
Chow CK Fatty Acids in Foods and their Health Implications, Chow CK eds, 1993; New York, Marcel Dekker Inc.
-
Siguel EN, Lerman RH Altered fatty acid metabolism in patients with angiographically documented coronary artery disease, Metabolism 1994 Aug;43(8):982-93.
-
De Lorgeril M, Salen P, Martin JL, Mamelle N, Monjaud I, Touboul P, Delaye J Effect of a mediterranean type of diet on the rate of cardiovascular complications in patients with coronary artery disease. Insights into the cardioprotective effect of certain nutriments, J Am Coll Cardiol 1996 Nov 1;28(5):1103-8. (e-mail: lorgeril@univ-st-etienne.fr)
-
Soyland E, Drevon CA The effect of very long-chain n-3 fatty acids on immune-related skin diseases, Eur J Clin Nutr 1993 Jun;47(6):381-8.
-
Simopoulos P Essential fatty acids in health and chronic disease. Presentation, The Third International Congress on Vegetarian Nutrition, March 1997.
-
Fischer M, Upchurch KS, Hoogasian JJ Effects of dietary fish oil supplementation on polymorphonuclear leukocyte inflammatory potential, Inflammation 1986;10:387-92.
-
Fanaian M, Szilasi J, Storlien L et al The effect of a modified fat diet on insulin resistance and metabolic parameters in type II diabetes, Diabetologia 1996;39(1):A7.
-
World Health Organization Study Group on Diet, Nutrition and the Prevention of Non-Communicable Diseases Diet, Nutrition and the Prevention of Chronic Diseases, World Health Organization 1991;Geneva, Swizerland: Technical Report Series No 797.
-
Health and Welfare Canada Nutrition Recommendations: the Report of the Scientific Review Committee, Ottawa: Supply and Services Canada, 1990.
-
Innis SA Essential fatty acids in growth and development, Progr Lipid Res 1991;30:39-103.
-
Nettleton JA Are n-3 fatty acids essential nutrients for fetal and infant development?, J Am Diet Assoc 1993 Jan;93(1):58-64.
-
Giovannini M, Agostoni C, Salari PC The role of lipids in nutrition during the first months of life, J Int Med Res 1991 Sep-Oct;19(5):351-62.
-
Galli C, Simopoulos AP, Tremoli eds Fatty acids and lipids: biological aspects, World Rev Nutr Diet 1994;75:1-196.
-
Roshanai F, Sanders TA Assessment of fatty acid intakes in vegans and omnivores, Hum Nutr Appl Nutr 1984 Oct;38(5):345-54.
-
Agren JJ, Tormala ML, Nenonen MT, Hanninen OO Fatty acid composition of erythrocyte, platelet, and serum lipids in strict vegans, Lipids 1995 Apr;30(4):365-9.
-
Haugen MA, Kjeldsen-Kragh J, Bjerve KS, Hostmark AT, Forre O Changes in plasma phospholipid fatty acids and their relationship to disease activity in rheumatoid arthritis patients treated with a vegetarian diet, Br J Nutr 1994 Oct;72(4):555-66.
-
Freese R, Mutanen M Alpha-linolenic acid and marine long-chain n-3 fatty acids differ only slightly in their effects on hemostatic factors in healthy subjects, Am J Clin Nutr 1997 Sep;66(3):591-8. (e-mail: riitta.freese@helsinki.fi)
-
Cunnane SC, Ganguli S, Menard C, Liede AC, Hamadeh MJ, Chen ZY, Wolever TM, Jenkins DJ High alpha-linolenic acid flaxseed (Linum usitatissimum): some nutritional properties in humans, Br J Nutr 1993 Mar;69(2):443-53.
-
Uauy R, Peirano P, Hoffman D, Mena P, Birch D, Birch E Role of essential fatty acids in the function of the developing nervous system, Lipids 1996 Mar;31 Suppl:S167-76.
-
Koletzko B, Thiel I, Springer S Lipids in human milk: a model for infant formulae?, Eur J Clin Nutr 1992 Dec;46 Suppl 4:S45-55.
-
Salomon Brothers A One-of-a-Kind biotech Company, Martek Biosciences Corporation 1996, Dec 11.
-
Sanders TA, Reddy S The influence of a vegetarian diet on the fatty acid composition of human milk and the essential fatty acid status of the infant, J Pediatr 1992 Apr;120(4 Pt 2):S71-7. (e-mail: sanders@kcl.ac.uk)
-
Sanders TA, FR Ellis and JW Dickerson Studies of vegans: the fatty acid composition of plasma choline phosphoglycerides, erythrocytes, adipose tissue, and breast milk, and some indicators of susceptibility to ischemic heart disease in vegans and omnivore controls, Am J Clin Nutr 1978 May; Vol 31(5) 805-813. (e-mail: sanders@kcl.ac.uk)
-
Innis SM, Nelson CM, Rioux MF, King DJ Development of visual acuity in relation to plasma and erythrocyte omega-6 and omega-3 fatty acids in healthy term gestation infants, Am J Clin Nutr 1994 Sep;60(3):347-52.
Published Online: 9 Nov 2000 (Updated 12 March 2002) — Copyright © by SSNV / All rights reserved.
Materiale didattico del Master Universitario in Alimentazione e Dietetica Vegetariana Funiber UNIVPM
Sitografia
https://www.scienzavegetariana.it/medici/essentialfat.html
https://www.scienzavegetariana.it/medici/acidigrassi.html